筆記整理:林均賢醫師
以下內容整理自由 2023 年台灣成人骨質疏鬆症防治共識指引。
上集已經將非藥物治療的部分做整理,下集主要針對骨鬆藥物的部分做說明。
骨鬆為什麼要用藥?可以吃鈣片就好嗎?
預防與治療骨質疏鬆症的最終目標在於減少骨鬆性骨折。
非藥物治療包括補充足量之鈣質與維生素 D、改善生活型態、戒菸、戒酒、適當運動及預防跌倒。
然而,對於具高骨折風險(併低骨量或骨鬆)或已發生骨鬆性骨折的患者而言,除了提供非藥物治療,應積極使用抗骨鬆藥物治療,因為接受藥物治療後可減少骨折的發生,甚至可以降低死亡率。
骨鬆藥物可以減少骨折
目前已有多種藥物通過大規模臨床試驗,可減少脊椎及脊椎外之骨折,亦可使用於男性骨鬆症或類固醇相關骨鬆症(GIOP)或其他次發性骨質疏鬆症。針對低骨量或骨鬆但尚未有骨鬆性骨折病史之骨折高風險患者,也已有治療藥物可積極降低骨鬆性骨折的發生。
與所有慢性病之治療概念類似(如治療高血壓可降低心血管疾病發生之風險),針對無骨鬆性骨折病史之低骨量患者(-2.5 < T-score < -1)的藥物治療可視為初級骨鬆性骨折預防; 而針對有骨鬆性骨折病史或骨質疏鬆患者(T-score ≤ -2.5)的治療則可視為次級骨鬆性骨折預防。
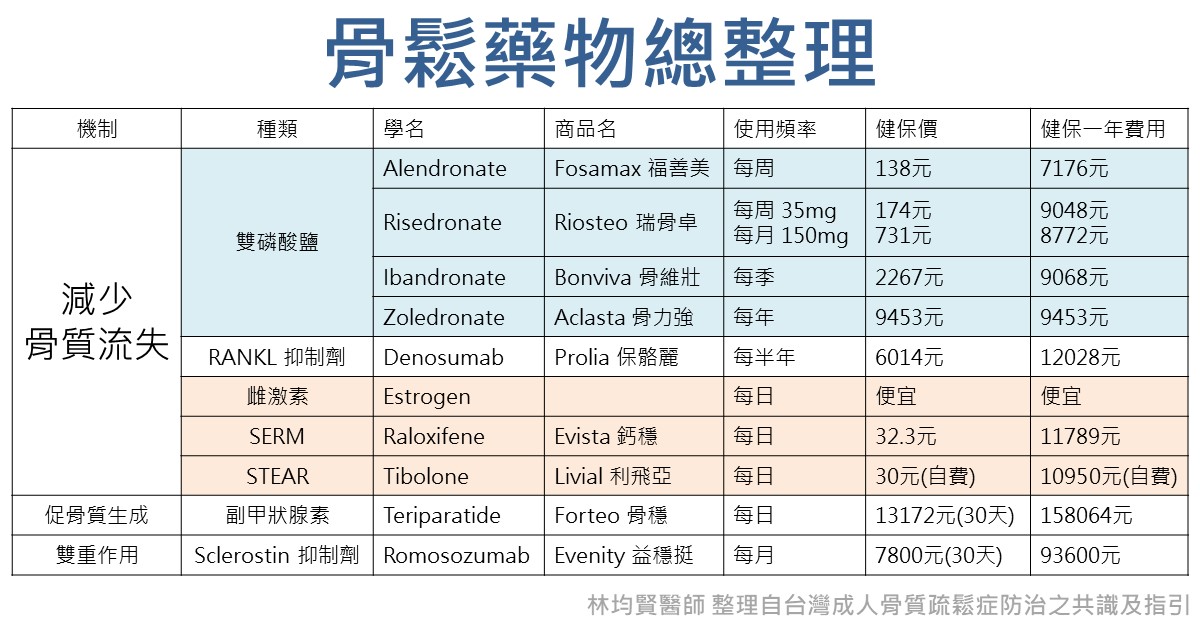
骨鬆藥物的種類
治療骨鬆及骨折的藥物依其機轉,分為減少骨質流失、促骨質生成,以及混合型藥物三類。
減少骨質流失 (抗骨質再吸收劑)
1. 雙磷酸鹽
2. 抑制 RANKL 單株抗體(denosumab)
3. 雌激素
4. 選擇性雌激素調節劑(selective estrogen receptor modulator, SERM)
5. 選擇性組織雌激素活性調節劑(selective tissue estrogenic activity regulator,STEAR)
促骨質生成劑:刺激造骨細胞之促骨質生成劑以副甲腺素及其活性片段為主。
混合型:雙重作用之混合型藥物,如抑制 sclerostin 單株抗體(romosozumab)。
藥物可以合併使用嗎?
依目前已發表的臨床試驗結果來看,合併使用藥物,除 teriparatide + denosumab 或 teriparatide + zoledronate可增加骨密度外 (但目前仍缺乏數據證實可有效降低骨折發生率),其他藥物之合併使用並無加成效果,反而會互相抵制,或是增加副作用之發生率或強度。
所以目前各國各種骨鬆防治指引,均不建議併用兩種破骨細胞抑制藥物,或是併用破骨細胞抑制藥物與造骨細胞刺激藥物。
骨鬆藥物治療時間與檢查項目
使用任何骨鬆藥物,建議檢查血中鈣、磷濃度以及腎功能等,評估低血鈣或腎功能變化。
使用骨鬆藥物的病人,不論任何藥物,治療需一年以上(最好持續三年)才真正可達減少骨折之效果,不宜太早停藥;累積藥量若不及一半,幾乎沒有骨折防治效果。
另外,在使用造骨細胞刺激藥物,如副甲狀腺素注射治療一年至一年半以後,固然可以明顯增加骨密度,但若停止治療,不再使用破骨細胞抑制藥物,原先增加之骨密度,幾乎又會流失殆盡。
其他如:SERM、雌激素、抑制 RANKL 單株抗體(denosumab)、抑制 sclerostin 單株抗體(romosozumab)等,在完全停止治療後,骨量也會有快速流失的情形,使原有的治療成果消失,甚至增加反彈性骨折機率。
所以就如同其他慢性病的治療一樣,停經後骨鬆及老年性骨鬆之治療,應有長期持續性與接續性執行規劃。醫師也宜告知病人治療之目標在於停止骨折發生,只要不再骨折,而骨密度沒有顯著減少,就是治療計畫成功。
骨鬆藥物誰效果最好?
對於具有極高骨折風險的骨質疏鬆症患者,可優先選擇 romosozumab、denosumab、teriparatide、zoledronate 作為初始療法。
其中治療效果卓越的 romosozumab 治療可至 1 年、teriparatide 治療至多 2 年。然而費用高昂。需考量健保給付之規範及醫病共享決策。
雙磷酸鹽藥物及 denosumab 則適用於大多數高風險骨折的骨質疏鬆症患者初始治療。
骨鬆藥物有何副作用?
治療骨質疏鬆症之藥物,在使用期間宜注意病人是否發生不適反應。
現今證據觀察到,高骨折風險病人繼續用藥的效益應會多於發生顎骨壞死之風險。
骨鬆藥物要治療多久?
相反的,若屬於骨密度穩定、未曾發生骨折、且屬骨折低風險發生之患者,宜評估繼續用藥之效益,是否持續用藥。
低骨折風險的患者停藥期間須做評估及追蹤,確保患者低骨折風險或骨鬆沒有惡化的情況。
根據研究,停用骨質疏鬆症藥物使用的患者,骨折之發生,相對風險較高,但由於雙磷酸鹽藥物會累積且可能在骨骼中作用時間延長(停藥後的存留治療效果),因此曾有建議適度考慮暫停使用雙磷酸鹽藥物,即“雙磷酸鹽假期(bisphosphonate holidays)”之概念。
雙磷酸鹽假期
依據使用不同骨質疏鬆症藥物可建議定期追蹤檢測 DXA及估算整體骨折風險。
對於口服雙磷酸鹽,如果骨折風險不再存在(例如 T 值高於 -2.5 或患者沒有發生骨折),則可在治療 5 年後暫停使用口服雙磷酸鹽。
如果骨折風險仍然高或極高風險患者,則可繼續延長 5 年治療(共 6 至 10 年)再評估是否暫停使用口服雙磷酸鹽。
對於注射針劑雙磷酸鹽如 zoledronate 在高風險患者中考慮 3 年後重新評估使用需求,或者直到骨折風險不再居高為止。
在極高風險患者中則建議持續 6 年治療再評估是否繼續治療。
雙磷酸鹽假期是否中止應基於個體患者的情況,例如骨折風險增加、骨密度降低幅度超過 DXA 的最小顯著差異值 (LSC),或骨代謝指標的明顯變化。
骨鬆藥物可以轉換使用
值得注意的是,造骨細胞生成劑及抑制 RANKL 單株抗體停藥後,骨密度會加速流失,故需銜接其他抗骨質再吸收類藥物,以保護骨密度,避免多發性骨折風險的發生。
接續療法(sequential therapy)用藥原則參考如下:
使用造骨細胞生成劑如(abaloparatide、teriparatide)或混合型藥物(romosozumab)後續宜使用抗骨質再吸收劑(如雙磷酸鹽、denosumab、raloxifene)接續治療,以防止骨密度下降及喪失了減少骨折風險的療效。
雙磷酸鹽藥物及 SERM 類藥物之後可以轉換到造骨細胞生成劑,但 denosumab 治療後轉換到造骨細胞生成劑後有髖部骨密度短暫流失的現象,雖會逐漸恢復增加,但仍應注意。
抗骨質再吸收劑之間可相互轉換,使用 denosumab 治療後可轉換到雙磷酸鹽類(如zoledronate 或 alendronate)或 SERM 類藥物,反之亦然。每次轉換藥物後宜持續至少 1-2 年以上,並再次評估是否需轉換至其它藥物接續治療。
更年期後女性病人的骨鬆治療
若更年期後女性病人不適合使用雙磷酸鹽或 denosumab,可考慮使用選擇性雌激素調節劑(selective estrogen receptor modulator, SERM)或選擇性組織雌激素活性調節劑(selective tissue estrogenic activity regulator, STEAR)或雌激素。
SERM 建議用於深部靜脈栓塞風險低或乳腺癌風險高的更年期後女性病人。
STEAR 或賀爾蒙療法 (子宮切除術的女性可單一使用雌激素療法)或可考慮用在以下更年期女性病人:
60 歲以下或停經少於 10 年、低深部靜脈栓塞風險、有顯著的停經血管舒縮症狀、有明顯更年期症狀、沒有禁忌症、沒有心肌梗塞、中風病史或乳腺癌病史。
藥物健保規範:簡要版
如果骨密度 T 值小於等於-2.5,再加上一處脊椎壓迫性骨折或髖部骨折,可健保給付使用減少骨質流失的藥物。
如果骨密度 T 值介於-1到-2.5之間,就要有兩處以上脊椎壓迫性骨折或髖部骨折,才可健保使用這些藥物。
若要使用較貴的增加骨質生成藥物「骨穩」、或是雙重作用的「益穩挺」,健保給付條件就更嚴格了:
骨密度 T 值須小於等於-3.0,需有兩處以上脊椎壓迫性骨折或髖部骨折,且須先使用別的藥物有不良反應或使用滿 1 年以上還發生新的骨折,才能健保給付使用。
完整與最新健保給付規定請以健保局公告為準。